「NEXWEETアルロースのタイトジャンクション制御による腸のバリア機能強化」
2024.05.011.研究背景1)
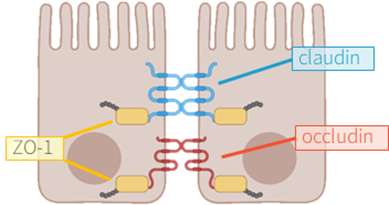
大腸の上皮障壁は大腸での物質透過を調節するのに重要な役割をする2)。正常的な細胞障壁は完璧な細胞間結合複合体(cell junctional complex)にを形成し、その中で密着結合タンパク質(Tight Junction proteins, 以下 TJタンパク質)はこのような構造と腸の透過性を維持するのに必須である。TJタンパク質は膜横断タンパク質で、アクチン細胞骨格と連結されたoccludin、claudin、ZO-1、 接合接着分子(junctional adhesion molecule、JAM)およびtricelluinなどがある3)。これらの結合力が弱くなると、隣接した二つの細胞の隙間を通じて外部の有害な物質が腸壁の中に流入するリーキーガット症候群(leaky gut syndrome) が発生する。これにより、免疫反応、炎症性腸疾患などの急性/慢性炎症疾患、食物アレルギーなどを誘発する4)。 つまり、腸の完全性(intestinal barrier integrity)を向上させ、腸壁を維持することが重要である。
2.実験方法および結果
実験は大腸上皮細胞(Intestinal Epithelial Cell)であるCaco-2細胞を利用してin vitroで行われた。 試料として三養社のNEXWEET結晶プシコースを(purity > 99%)を使用した。Caco-2細胞は分化しながら分極(polarization)現象が発生し、断層(monolayer)を形成する特徴がある。 Caco-2細胞断層を基準に、 頂端側(apical)と側底側(basolateral)が区切られて、物質の移動が制限される。 しかし、炎症を起こす物質であるLPS(lipopolysaccharides)または炎症性サイトカイン(TNFα/IFNγ)によってバリアに損傷が生じ、細胞の間に物質の流れが発生する5)。
1)細胞間透過性確認実験
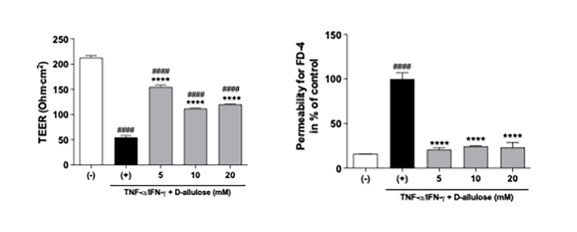
細胞間透過性確認のために2つの実験を行った。 まず細胞層を挟んで電気抵抗を測定する「TEER(Transepithelial electrical resistance)」実験を通じて細胞バリア形成を評価した。次に、高分子(dextran)物質に蛍光(FITC)を標識した試料を処理して物質の透過有無を蛍光分析を通じて確認した。
その結果、サイトカインにより減少していたTEER数値がプシコースで処理した際に再び回復する傾向を確認した。 FITC-dextran透過実験でもサイトカイン処理により増加していた透過がプシコース処理時に減少する傾向を示した。 これはプシコースの処理が細胞層形成を回復させると理解できる。
2)TJタンパク質の発現量を確認
細胞間バリア形成に影響を及ぼすTJタンパク質の中、ZO-1、occludin、claudin-1の生成量を確認するためにmRNA発現量とタンパク質の発現量を確認した。発現量及び発現部位の確認するために免疫蛍光法 (immunofluorescence)も実施し、細胞におけるTJタンパク質の発現位置を確認した。
実験結果として、腸の上皮細胞にLPS処理によって減少したclaudin-1、occludin、ZO-1の発現量がプシコース処理によって増加することを確認した。また、免疫蛍光実験で各TJタンパク質の発現量及び位置を確認し、特にClaudin-1とZO-1に対しては同じ位置に発現されるコローカリゼーションを確認した。

3)炎症性因子測定
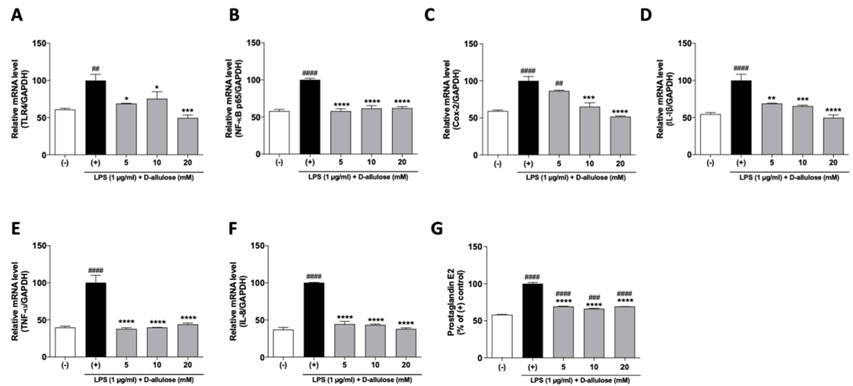
炎症誘発因子であるLPSは細胞のToll-like receptor 4(TLR4)で認識しながら炎症関連メカニズムを活性化させる。このメカニズムを通じて炎症性サイトカイン (pro-inflammatory cytokines)の発現が増加し、結果的には上皮細胞のバリア機能(epithelial barrier function)を弱化させる役割をする6)。
その結果で、Caco-2細胞にLPSを処理すると、炎症性サイトカインのmRNA転写が増加する。さらに炎症反応に関与するProstaglandin E2(PGE2)の生成量が増加する。一方、プシコースと一緒に処理すると、炎症性サイトカインの量が減少し、PGE2の生成量も減少する。
3.おわりに
本研究はプシコースがTJタンパク質ZO-1、occludinおよびclaudin-1を上方調整することで、腸の完全性を向上させるということを立証した。 また、プシコースはTLR4によって発現されるNF-κBシグナル伝達経路を抑制し、炎症性サイトカインの生成を調節すると判明した。 このような三養社のNEXWEETプシコースの有益な効果は、腸のバリア機能強化及び炎症抑制、腸の機能障害改善のための機能性食品または飲料の潜在的な食事サプリメントとして重要な役割を果たす。 細胞ベースの実験で観察された効果は、実際の製品での結果を完璧に予測できない可能性があるため今後、動物および臨床実験を通じて適切な濃度を確認する必要がある。
<<<< 参考文献 >>>>
1)Baek J, et al. : J. Funct. Foods, 108, 105721 (2023)
2)Catalioto R M, et al. : Curr. Med. Chem., 18(3), 398–426 (2011)
3)Chelakkot C, Ghim, J., & Ryu, S. H. : Exp. Mol. Med., 50(8), 1–9 (2018)
4)Anderson J. M & Van Itallie C. M : Am. J. Physiol., 269(4 Pt 1), G467–G475 (1995)
5)He C, et al. : Food Funct., 10(2), 1235–1242 (2019)
6)Lee S. H, et al. : Intest. Res., 13(1), 11–18 (2015)
7)Ma T. Y, et al : Proc. Soc. Exp. Biol. Med, 214(4), 318–327. (1997)
8)Ouyang F, et al. : Metabolites, 12(11), Article 1028. (2022)
9)Al-Sadi R, et al. : Am. J. Physiol., 300(6), G1054–G1064 (2011)
10)Chen Y, et al. : J. Neurogastroenterol. Motil., 26(3), 397–409 (2020)
11)Ciesielska A, et al. : Cell. Mol. Life Sci., 78(4), 1233–1261 (2021)
12)Dheer R, et al. : Infect. Immun., 84(3), 798–810 (2016)
13)Luo H, et al. : PLoS ONE, 7(10), Article e46291 (2012)
ファン・ファンジュ/Hwang Hwanju
株式会社三養社 素材開発P/G Researcher
2018年ソウル大学農生命工学部修士課程修了、2019年三養社入社。
出所 : 株式会社 食品化学新聞社 2024.05発刊 FOODSTYLE21

